Анаэробная неклостридиальная инфекция мягких тканей
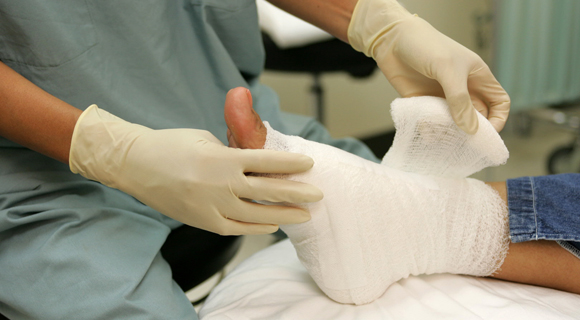
После хирургической обработки рана должна быть максимально раскрыта. Это достигается путем разворачивания оставшихся отсепарированными от подкожной клетчатки до собственно дермы кожных лоскутов (от краев раны до границ интактных тканей) с последующим их выворачиванием, укладыванием на стерильные марлевые тампоны и подшиванием в сформированном положении, с учетом сохранения кровоснабжения к непораженным участкам кожи. Этим приемом обеспечивается визуальный контроль за течением раневого процесса, лучшая аэрация раны, которая оказывает губительное действие на неклостридиальные анаэробы. Известно, что неспорообразующая анаэробная микрофлора весьма чувствительна к действию атмосферного кислорода, под воздействием которого в лабораторных условиях она гибнет в течение нескольких часов.
После хирургической обработки лечение ран сложной конфигурации с поражением нескольких анатомических областей при наличии глубоких межмышечных карманов целесообразно проводить под повязками с использованием современных осмотически активных мазей на водорастворимой основе (5% диоксидиновая мазь, левосин, левомеколь) до перехода раневого процесса во вторую фазу.
Указанные мази, оказывая на рану комплексное (дегидратирующее, некролитическое, антимикробное, противовоспалительное, обезболивающее) действие, способствуют сокращению некролизиса, ускорению появления грануляций и начала эпителизации.
В то же время при АНИ при сопоставлении сроков исчезновения неспорогенных анаэробов и аэробных возбудителей установлено, что снижения обсемененности раны ниже 10s микробных тел в 1 г ткани возможно достичь только к 10—14-м сут, в то время как при только аэробной микрофлоре этого удается достигнуть к 4—б-м сут лечения теми же мазями, что объясняется прежде всего особенностями течения раневого процесса при этом специфическом виде инфекции.
При поверхностных плоских ранах вне зависимости от их размеров оправдано использование управляемой абакгериальной среды с давлением 1,3— 2,0 кПа, потоком воздуха 45—50 м3/ч, относительной влажностью 70—75% и температурой 28—32°С. Применение аэротерапевтической установки (АТУ-3) позволяет, наряду с бактериально чистой средой внутри изолятора, регулировать в нем давление и температуру воздуха, создавая тем самым благоприятные условия для течения раневого процесса.
Очищение раны от некротических масс, появление грануляций, исчезновение отека в большинстве случаев позволяет через 10—14 сут закрыть рану местными тканями или аутодермопластикой с последующим ведением ее в управляемой абакгериальной среде.
Многокомпонентная интенсивная терапия является обязательным составным компонентом лечения больных с АНИ. Это связано с особенностями течения этого специфического вида инфекции, вовлечением в патологический процесс обширных массивов мягких тканей, выраженной интоксикацией, а также наличием обширных раневых поверхностей, образовавшихся после хирургической обработки неклостридиальной флегмоны.
Интенсивную терапию проводили на основании разработанных принципов, согласно которым при выборе каждого из ее компонентов следует ориентироваться на радикальность проведенного оперативного вмешательства, динамику основных клинико-лабораторных данных, включая показатели интоксикации, состояния питания, а также внешнего дыхания, газов крови, энергетического и углеводного обмена.
Объем интенсивной терапии необходимо рассчитать с учетом показаний к введению донорской крови и препаратов крови, белковых, целенаправленных антибактериальных и иммунных препаратов, ориентируясь не только на физиологические потребности в воде и электролитах, но и сообразуясь с потерями жидкости через обширные раневые поверхности (15— 25% поверхности тела). При этом, как показывают наши исследования, тяжесть состояния больных обусловлена не* только интоксикацией и анемией, но и в значительной степени — нарушениями водно-электролитного баланса и крайне высокими их потерями. Так, суточные потери жидкости при обширных раневых поверхностях у 45% больных достигали 6,5 л, калия с экскрецией через почки и с раневым экссудатом — 250 ммоль, натрия — 455 ммоль, азота — 0,4 г с каждых 100 см2 раны, превышая тем самым физилогические потребности в 1,5—2 раза. Нами установлено, что при проведении интенсивной терапии у больных с АНИ и площадью поражения до 500 см2 нормализация функций систем и органов наблюдается при устранении патологического очага при возможно раннем закрытии раны. У лиц с зоной поражения мягких тканей, превышающей 1000 см2 и более, несмотря на полное своевременное закрытие раневой поверхности, их нормализация происходит значительно позже, что следует учитывать при лечении и реабилитации больных.
Особое значение имеет отечественный антибактериальный препарат диоксидин из группы производных димокси-хиноксалина.
Диоксидин активен в отношении B.fragilis в концентрациях 0,065—2 мкг/мл; B.melaninogenicus, Peptococcus, Peptostreptococcus 0,5—2 мкг/мл, Fusobacterium — 0,125—2 мкг/мл.
Установлено, что многие неклостридиальные анаэробы обладают резистентностью к действию традиционно используемых антибиотиков (бензилпенициллин, цефалоспорины) вследствие образования этими микроорганизмами ферментов (бета-лактамаз), которые разрушают бета-лактамное кольцо антибиотиков. Поэтому были разработаны и внедрены в практику соединения, инактивирующие бета-лакгамазы бактерий. К ним относятся: клавулановая кислота, сульбактам и тазобакгам. Как правило, они применяются в комбинации с бета-лактамными антибиотиками (ампициллин, амоксициллин, пиперациллин), что существенно расширяет спектр их активности, включая и воздействие на анаэробную неспорогенную микрофлору. К другим соединениям, имеющим определенное структурное сходство с бета-лактамными антибиотиками и характеризующимся высокой устойчивостью к действию беталактамаз и выраженным бактерицидным действием, относятся карбапенемы (имипенем и меропенем). Вместе с тем, несмотря на высокую эффективность, эти препараты пока не нашли широкого применения в клинике, ввиду их дороговизны и недоступности практическому здравоохранению.
Однако, следует подчеркнуть, что использование самых современных целенаправленных антибактериальных препаратов против АНИ будет неэффективным, если не выполнено радикальное хирургическое вмешательство.
Лечение целесообразно начинать с внутривенного введения метронида-зола или клиндамицина фосфата и при положительной динамике раневого процесса, снижении температуры тела, улучшении состояния больного необходимо продолжить лечение, используя «твердые» лекарственные формы (таблетки, капсулы, ректальные свечи).
После идентификации возбудителей раневой инфекции необходима коррекция антибактериальной терапии, исходя из данных чувствительности микрофлоры. При выявлении грамотрицательной микрофлоры показано использование современных аминогликозидов: гентамицина, сизомицина, тобрамицина, амикацина, нетромицина, нетилмицина, а также 1% раствора диоксидина, 0,1% раствора фурагина калия, цефалоспоринов.
Критерием эффективности общей антибактериальной терапии помимо регрессии общеклинических симптомов воспаления является исчезновение патогенной микрофлоры из ран, либо снижение бактериальной обсемененности раны ниже 105 микробов в 1 г ткани раны.
В большинстве наблюдений проведенный комплекс мероприятий способствовал достижению положительной динамики течения раневого процесса в течение 12—14 сут, что позволило закрыть рану пластикой местными тканями, наложением ранних вторичных швов с проточным дренированием или дерматомной кожной пластикой свободным сетчатым лоскутом. При этом благоприятные исходы восстановительных операций удалось получить в 88% наблюдений, при снижении летальности до 15%.
В процессе работы нами установлено, что у больных с АНИ на фоне сахарного диабета до поступления в стационар, на разных этапах лечения допускается целый ряд врачебных ошибок. Классифицировать их можно следующим образом.
Диагностические ошибки. Они чаще всего сводятся к недооценке или неверной трактовке клинических симптомов АНИ. Инфекционный процесс нередко диагностируется, как воспалительный инфильтрат, иногда как «банальная флегмона». Отсутствие гноя при диагностической пункции сдерживает хирургов от оперативного вмешательства. Когда при относительном «визуальном» благополучии появляются симптомы гнойно-резорбтивной лихорадки или сепсиса и компенсации сахарного диабета нет, несмотря на интенсивную инсулинотерапию, у врача не возникают подозрения о возможности развития АНИ, так как не используются доступные методы экспресс-диагностики. В связи с этим диагностический период непозволительно удлиняется.
Тактические ошибки. Они также связаны с незнанием особенностей клинического течения указанной патологии. Прежде всего, это отказ от своевременной и радикальной хирургической обработки гнойного очага или выполнение неадекватной хирургической обработки, ограничивающейся только рассечением кожи и подкожной основы небольшими линейными разрезами без удаления пораженных тканей. Это приводит к прогрессированию заболевания, нарастающей тяжелой интоксикации, сепсису.
К тактическим ошибкам относится использование рутинных методов дренирования ран либо брюшной полости.
Для больных сахарным диабетом значительную опасность представляет необоснованная поспешность в проведении радикальной хирургической обработки без проведения компенсации гомеостаза, прежде всего, углеводного обмена. Ошибку и опасность представляет неадекватная антибактериальная терапия, проводимая без учета анаэробного компонента микрофлоры, а также многокомпонентности микробных ассоциаций.
Наконец, при лечении больных с АНИ следует помнить о необходимости контроля за течением раневого процесса в виду угрозы прогрессирования инфекции, наряду с проведением адекватной интенсивной терапии.
Организационные ошибки. Все они непосредственно связаны с уровнем врачебной квалификации и в значительной степени зависят от опыта работы в отделении ран и раневой инфекции. Отметим важнейшие организационные ошибки: во-первых, пренебрежение правилами профилактики АНИ, т.е. отсутствие выделения перед операцией больных в группу повышенного риска, не использование целенаправленных антианаэробных препаратов, неверно выбранная врачебная тактика.
Во-вторых, длительное пребывание больных в хирургических стационарах районных или городских больниц с неустановленным диагнозом АНИ.
Наконец, несвоевременное привлечение к процессу лечения высококвалифицированных специалистов соответствующего профиля. Ошибочным считается мнение, что вопросами хирургической инфекции могут заниматься начинающие, либо малоопытные врачи, весь технический и лечебный арсенал которых сводится к рассечению, опорожнению гнойника, нередко под местной анестезией и тампонированию раны с использованием традиционных лекарственных средств.
Таким образом, своевременная диагностика АНИ, применение активного хирургического лечения и проведение многокомпонентной интенсивной терапии с использованием целенаправленных антибактериальных препаратов позволяют значительно снизить летальность, сократить сроки и существенно улучшить результаты лечения.
- Предыдущие статьи из рубрики: Сахарный диабет и хирургические заболевания

 Дисбаланс микроэлементов крови
Дисбаланс микроэлементов крови Система гемостаза у больных сахарным диабетом
Система гемостаза у больных сахарным диабетом Послеоперационный период у больных сахарным диабетом
Послеоперационный период у больных сахарным диабетом Методы обезболивания больных сахарным диабетом
Методы обезболивания больных сахарным диабетом Предоперационная подготовка больных сахарным диабетом
Предоперационная подготовка больных сахарным диабетом