Функции транспортных белков
Активность фосфолипидов
Метаболизм PAF. Избыточное образование фактора, активирующего тромбоциты (PAF), может вести к развитию патологического процесса. Наиболее эффективным способом ограничения действия PAF служит отщепление от PAF короткой ацильной группы в положении 2. Гидролиз осуществляет специфичная в отношении PAF ацетилгидро-лаза (PAF-AH), относящаяся к семейству фосфолипаз А2. Клонировано несколько изоформ фермента, одна из которых находится в плазме крови в комплексах с липопротеидами низкой и высокой плотности. Другие изоформьг локализуются внутри клеток. PAF-AH участвует также в разрушении подобных PAF окисленных фосфолипидов. Образовавшийся лизо-PAF далее может быть реацилирован с помощью фермента ацил-КоА: 1-алкилглицеро-З-фосфохолинацилтрансферазьг. Другими направлениями метаболизма PAF являются отщепление алкильной части лизо-PAF под действием алкилмонооксигеназы с образованием альдегида и катализируемый фосфолипазой D гидролиз фосфохолиновой части с образованием аналога фосфатидной кислоты. Аналога PAF, содержащие ацил вместо 1-алкила, могут разрушаться фосфолипазой А1, гидролизующей сложноэфирную связь остатка длинноцепочечной жирной кислоты в положении 1, с образованием 1 -лизо-2-ацетилглицеро- 3-фосфохолина.
Активность PAF-AH возрастает при воспалительных процессах, таких как системная красная волчанка, что может служить фактором, ограничивающим дальнейшее развитие воспаления. Одним из механизмов регуляции активности PAF-AH является комплексирование фермента с липопротеидами. Например, при болезни коронарной артерии характерно ингибирование каталитической эффективности PAF-AH аполипопротеином А, что может усугублять течение болезни.
Тиреоидные гормоны
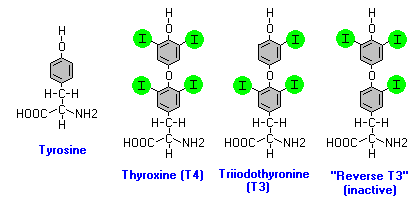
У человека на долю малоактивного Т4 приходится более 90% сек-ретируемых тиреоидных гормонов. Активный гормон (Т3) на 80% образуется при активирующем 5′-дейодировании Т4 в периферических тканях. Дейодирование служит также одним из путей инактивации тиреоидных гормонов. Клонировано три йодтирониндейодиназы (Dl—D3), катализирующие активирующее и/или инактивирующее дейодирование.
Дейодиназы относятся к группе белков, содержащих селен. Интересно, что селеноцистеин включается в белок при его трансляции за счёт превращения стоп-кодона UGA в кодон селеноцистеина в результате образования в мРНК структуры «ствол—петля». Механизм дейодирования включает перенос йодида на селен фермента с последующим восстановлением тиоловым кофактором. Тиреостатики тиоурацил и его производные, применяемые для лечения больных гипертиреозом, образуют необратимые комплексы с селеном фермента D1, блокируя тем самым его дейодиназную активность. Недостаточность поступления селена в организм сопровождается снижением превращения Т4 в Т3.
Только D1 способен катализировать дейодирование и наружного, и внутреннего колец йодтиронинов. В клетке, по-видимому, локализован на плазматической мембране с каталитическим центром, обращенным в цитоплазму. У человека экспрессируется в печени, почках, гипофизе, щитовидной железе, мононуклеарных клетках крови. Одним из индукторов фермента являются тиреоидные гормоны, что может служить причиной усугубления гипертиреоза за счёт усиления образования Т3 под действием фермента D1. Индукторами фермента также являются ретиноевая кислота, глюко-кортикоиды, гормон роста, ТТГ (в щитовидной железе). Ряд цитокинов (ИЛ-1(3, TNFa, ИФНу) подавляют экспрессию фермента, что может лежать в основе подавления тиреоидной функции при тяжёлых болезнях. При голодании образование Т3 уменьшается, возможно, благодаря снижению уровня фермента D1 и, по-видимому, служит фактором адаптации интенсивности обмена к поступлению пищи.
Различия функций
Изозим D2 катализирует дейодирование только наружного кольца йодтиронинов. Локализуется на мембранах эндоплазматического ретикулума. Различия во внутриклеточной локализации изозимов D1 и D2, по-видимому, определяют различия функций двух белков: D1 преимущественно обеспечивает экспорт Т3, а D2 снабжает Т3 продуцирующую его клетку. У человека экспрессируется в щитовидной железе, сердце, головном и спинном мозге, скелетной мышце, плаценте, коже. Для фермента характерна зависимая от субстрата быстрая протеолитическая деградация, что служит фор-мюй буферирования колебаний уровня тиреоидных гормонов. Активность D2 позитивно регулируется факторами, повышающими уровень цАМФ в клетке: норадреналином и глюкагоном в буром жире, тиротропином в щитовидной железе, а также инсулином, и илтгибируется гормоном роста. В отличие от регуляции изозима D1, экспрессия D2 подавляется тиреоидными гормонами.
Изозим D3 катализирует почти исключительно дейодирование в нутреннего кольца йодтиронинов и является главным Т3 и Т4-инактивирующим ферментом (Т4-> гТ3, Т3 -» 3,3′-Т2), поскольку оба продукта дейодирования гормонально неактивны. Избыточный биосинтез D3 в гемангиомах печени человека ведёт к тяжелому гипотиреозу, а гиперэкспрессия у головастиков — к блокировке метаморфоза. Играет важную роль в защите тканей эмбрионов от избыточного действия тиреоидных гормонов. У человека экспрессируется в мозге, особенно в пирамидных нейронах гиппокампа, зернистых клетках хвостатого ядра, слоях II—IV коры мозга, т.е. в отделах, связанных с обучением, запоминанием, когнитивными функциями. У новорождённых крыс временно индуцируется преимущественно в областях, связанных с половой дифференцировкой мозга. У человека обнаруживается на высоком уровне в плаценте и печени плодов. Экспрессию фермента индуцируют тиреоидные гормоны, ретиноевая кислота и ряд факторов роста. СТГ и глюкокортикоиды подавляют активность фермента.
Функции дейодиназ
В соответствии с особенностями каталитических свойств, тканеспецифичности и регуляции экспрессии, функции дейодиназ существенно различаются. Изозим D2 участвует в системе обратной связи тиреоидных гормонов на гипофизарном и гипоталамическом уровне. Соотношение Т4 и Т3 в плазме, являющееся функцией изозимов D1 и D2, относительно стабильно. Уровень Т3 в конкретной ткани зависит от активности в данной ткани изозимов Ю2 и D3. Вклад Т3, образованного местно под действием D2, в общий пул Т3 в клетке, является минимальным в почках и печени, близок к 50% в гипофизе и максимален в коре мозга (80%). Индукция термогенеза в буром жире грызунов при охлаждении, обеспечиваемая, в частности, за счёт усиления экспрессии рассопрягающего белка UCP1 и ферментов липосинтеза, включает значительное увеличение локального образования Т3 под действием дейодиназы D2 без существенного повышения секреции тиреоидных гормонов ((Т3 действует синергично с норадреналином на промотор UCP1). Нокаут гена D2 у мышей нарушает систему обратной связи продукции тиреоидных гормонов (двукратное повышение ТТГ и Т4) и блокирует адаптивный термогенез в буром жире.
Помимо дейодирования, тиреоидные гормоны могут подвергаться ряду других превращений: разрыву дифенилэфирной связи и характерным для обмена аминокислот реакциям окислительного де-заминирования и декарбоксилирования боковой цепи. Кроме того, тиреоидные гормоны и их метаболиты могут выводиться из организма путём образования парных соединений с серной и глюкуроновой кислотами — реакций, катализируемых сульфо- и глюкуро-нозилтрансферазами (см. метаболизм стероидов). Показано сульфирование йодтиронинов с разной субстратной предпочтительностью, катализируемое сульфотрансферазами SULT1C1, SULT1B1, SULT1B2, SULT1A1, SULT2A1, SULT1E1. У плодов сульфойодтиронины могут служить запасной формой тиреоидных гормонов, которые могут быть реактивированы гидролизом эфирной связи под действием сульфатаз (в частности, арилсульфатазы С).
Окислительное дезаминирование
Ключевыми реакциями метаболизма катехоламинов служат окислительное дезаминирование, катализируемое двумя группами ферментов, моноаминооксидазами (МАО) и аминоксидазами, содержащими медь, а также О-метилирование одного из гидроксилов катехоловой фугшировки, катализируемое катехол-О-метилтрансферазой. Дезаминирование снижает, но не блокирует полностью биологическую активность катехоламинов. Метилирование инактивирует катехоламины более эффективно. Указанные пути метаболизма могут сходиться, в результате чего основная часть метаболитов дезаминирована и метилирована. В катализе дезаминирования количественно преобладает действие изозима МАОА (предпочтительным субстратом для изозима МАОВ является фенилэтиламин). Нокаут гена МАОА у мышей, как и инактивирующие мутации у человека, ведёт к повышению уровня серотонина, норадреналина и дофамина в мозге и повышенной агрессивности (синдром Бруннера). Нокаут гена МАОВ остаётся без выраженных фенотипических проявлений. Второй тип ферментов, катализирующих окислительное дезаминирование (содержащие медь аминооксидазы), экспрессируемый преимущественно клетками эндотелия лимфатических узлов и печени, а также адипоцитами, играет важную роль в клеточной адгезии лимфоцитов при их возвращении в кровоток. Метилирующий фермент — катехол-О-метилтрансфераза — образуется в двух формах, растворимой и связанной с мембранами. Кроме катехоламинов (дофамина, норадреналина и адреналина) в качестве субстратов может использовать катехолсодержащие лекарственные препараты и катехолэстрогены.
Продукты действия МАО и содержащих медь аминооксидаз имеют в боковой цепи реакционноспособную, потенциально токсичную альдегидную группу, и быстро превращаются либо в гликоли (реакцию восстановления катализируют альдегид- и альдозоредуктазы), либо в карбоновые кислоты (преобладающий путь, катализируемый альдегиддегидрогеназами). Исходные катехоламины и их метаболиты могут образовывать парные соединения с глюкуроновой и серной кислотой под действием глюкуронил- и сульфотрансфераз, что облегчает их выведение из организма.
- Предыдущие статьи из рубрики: Эндокринология